
Подготовка научно-медицинской документации для фармацевтических производителей
Обобщенная критическая оценка доклинических исследований лекарственного препарата на животных, in vitro, также обсуждение и обоснование стратегии исследования при необходимости отклонения от соответствующих требований. Обзор литературы включает три основных раздела:
I. Резюме фармакологических данных
II. Резюме фармакокинитеческих данных
III. Резюме токсикологических данных

Обзор клинических данных включает обобщенную критическую оценку клинических исследований препарата на людях, состоит из:
I. Резюме исследований клинической фармакологии,
II. Резюме клинической эффективности
III. Резюме клинической безопасности
IV. Краткий обзор индивидуальных исследований
V. Краткого библиографического описания использованных источников
















В соответствие с N 61-ФЗ (ред. от 29.12.2015) «Об обращении лекарственных средств» Статья 18.
вместо отчета разработчика о результатах собственных доклинических исследований лекарственных средств и клинических исследований лекарственных препаратов для медицинского применения обзора научных работ
> Гарантируем результат в течение 2 лет после сдачи текста
> Ускоряем процесс регистрации
> Удешевляем процесс
> Ускоряем вывод воспроизведенного продукта на рынок
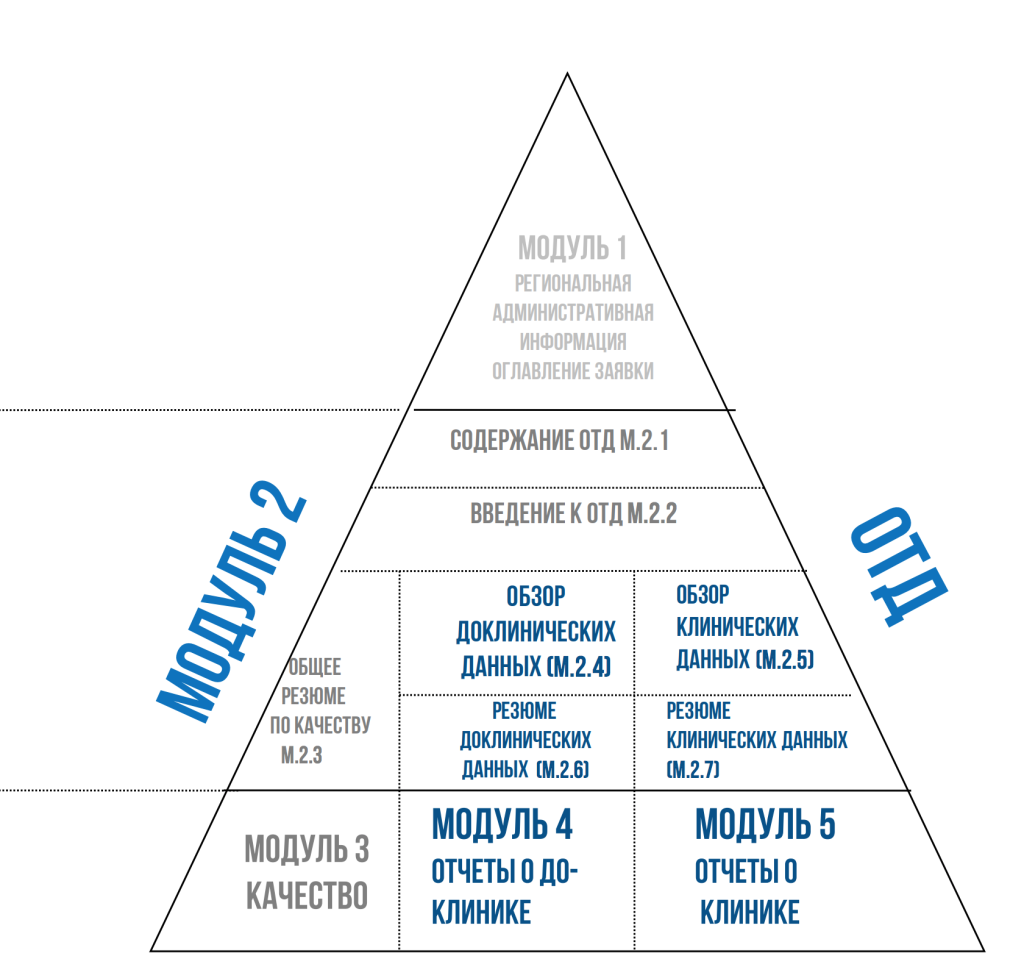
Для регистрационных задач лекарственных средств в формате Общего технического документа мы выполняем написание обзоров литературы для модулей:
М. 2.4-2.5 (доклинический и клинический обзор)
М. 2.6-2.7 (доклиническое и клиническое резюме
Модуль 4 (результаты собственных доклинических исследований, доклинический отчет)
Модуль 5 (результаты собственных клинических исследований, клинический отчет)
Наши консультанты помогут ответить Вам на этот вопрос: воспроизведенные препараты различных классов, гибридные препараты, биоаналоги, для всех групп препаратов существуют свои особенности, мы готовы помочь Вам в стратегии регистрации до начала проекта
Да, мы сопровождаем клиента до успешной регистрации препарата и при необходимости вносим правки в предоставленный материал в течение 2х лет. |
При необходимости мы можем задействовать до 10 авторов и выполнять заказ исследовательской группой, что позволяет серьезно сократить итоговый срок выполнения заказа. |
Команда состоит из квалифицированных врачей и специалистов в биомедицинских науках, отобранных по России и СНГ и обученных по внутренней системе подготовки кадров НМА Литобзор. Опыт авторов в написании научных текстов достигает 22 лет.
В итоге заказчик получает комплект материалов — научный обзор литературы с внутренним цитированием научных источников и итоговым библиографическим списком литературы. Материалы готовы для включения в регистрационное досье или для подачи в Минздрав РФ в качестве информационного обоснования.
НМА Литобзор — агентство с длительной историей работы в области медицинской информации. Мы разработали и поддерживаем внутреннюю систему контроля качества работ; В работе используются российские и зарубежные базы данных, начиная от Elibrary, бумажных каталогов ЦНМБ ПМГМУ им. И.М. Сеченова и серой литературы, Pubmed и Embase до отчетов EMA, FDA. В ходе работ используются научная литература на английском, немецком, французском, а также оригинальные отчеты на азиатских языках
Два года достаточный срок для подачи большинства регистрационных досье. Если регулятор направит Вам замечания и уточнения на обзор, то наша система контроля качества оперативно обрабатывает запрос. Вполне возможно, что идентичный запрос уже поступал на этот же текст после сдачи версии Вам, поэтому у нас уже может быть обновленный текст, утвержденный регулятором и запрос будет обработан максимально быстро.
За 2015-2018 годы (с даты вступления поправки к Федеральному закону №61) агентство Литобзор выполнило 182 проекта по регистрации лекарственных средств с использованием обзоров научных работ.
В общей сложности 268 обзора из низ 163 — обзоры доклинических исследований, 105 — обзоры клинических исследований лекарственных средств для регистрационных целей.
Среди них инъекционные формы, твердые и мягкие лекарственные формы. Комбинированные и «монопрепараты».
В момент сдачи текста наша работа не заканчивается, мы делаем актуализации обзоров в среднем каждые 3 месяца, поэтому наш клиент может быть уверен, что в регистрационное досье лекарственного средства попадет самая свежая информация по безопастности и эффективности препарата.

По телефону, почте или на сайте.
Мы со своей стороны делаем бесплатную экспертизу проекта: история обращения лекарственного средства на территории, где планируется подача. Изучение объема научной литературы по доклиническим и клиническим исследованиям референтного препарата;

Консультирование заказчика по сложившейся регуляторной практике относительно лекарственной группы и лекарственной формы. Изложение потенциальных рисков при регистрации и подготовка плана будущего обзора литературы в составе регистрационного модуля;

Подготовка обзоров научных работ и составление рекомендаций (при необходимости) по необходимому объему собственных доклинических и клинических исследований Заказчика;

У регулятора возникли вопросы по обзору? Мы дополним тексты и составим грамотное обоснование
Поручите подготовкуобзора литературы профессионалам

Наш офис находится по адресу:
г. Москва, Озерковская наб. 50 стр. 1, офис 26
Email: info@lit-review.ru
Телефон: + 7 (495) 646-49-75
Ответственный за практику медицинского письма (medical writing):
Мильчаков Кирилл Сергеевич, к.м.н.
Подготовка обзорных текстов для регистрационного досье в соответствии Федеральным законом от 12.04.2010 N 61-ФЗ (ред. от 29.12.2015) «Об обращении лекарственных средств» и в формате Общего технического документа (модули 2.4-2.7, 4 и 5) по Решению №78 ЕАЭС

(с) НМА Литобзор — информационное агентство доказательной медицины №1: обзор литературы, райтерские услуги, статистическая обработка данных для исследовательских и маркетинговых проектов в области медицины и фармацевтики
Статьи по биостатистике, клинической эпидемиологии, регуляторике обращения лекарственных препаратов
