
Подготовка научно-медицинской документации для фармацевтических производителей
Краткая информация, чтобы мы могли с Вами связаться: ответить на вопросы и что-то посоветовать
Обзоры доклинических и клинических исследований препаратов для регистрации лекарственного препарата
Запросить коммерческое предложение — несложно, мы постараемся максимально быстро проанализировать Ваш проект и предложить готовое решение
- Ваши Персональные данные под защитой.
Наши обзоры литературы помогают фармацевтическим производителям регистрировать генерические продукты быстрее в 2 раза, экономя до 30% бюджета, с гарантией результата в течение 2х лет
Консультации бесплатные, ёмкие и полезные:
- Готовим и актуализируем обзоры по большому спектру малых молекул и биоаналогов
Обобщенная критическая оценка доклинических исследований лекарственного препарата на животных, in vitro, также обсуждение и обоснование стратегии исследования при необходимости отклонения от соответствующих требований. Обзор литературы включает три основных раздела:
I. Резюме фармакологических данных
II. Резюме фармакокинитеческих данных
III. Резюме токсикологических данных
Обзор доклинических исследований может заменить собственные доклинические исследования производителя и сэкономить ресурсы заявителя
Краткая информация, чтобы мы могли с Вами связаться: ответить на вопросы и что-то посоветовать
Обзоры доклинических и клинических исследований препаратов для регистрации лекарственного препарата
Запросить коммерческое предложение — несложно, мы постараемся максимально быстро проанализировать Ваш проект и предложить готовое решение
- Ваши Персональные данные под защитой.

Обзор клинических данных включает обобщенную критическую оценку клинических исследований препарата на людях, состоит из:
I. Резюме исследований клинической фармакологии,
II. Резюме клинической эффективности
III. Резюме клинической безопасности
IV. Краткий обзор индивидуальных исследований
V. Краткого библиографического описания использованных источников
Обзор клинических исследований может заменить собственные результаты клинических исследований и сэкономить ресурсы заявителя
Краткая информация, чтобы мы могли с Вами связаться: ответить на вопросы и что-то посоветовать
Обзоры доклинических и клинических исследований препаратов для регистрации лекарственного препарата
Запросить коммерческое предложение — несложно, мы постараемся максимально быстро проанализировать Ваш проект и предложить готовое решение
- Ваши Персональные данные под защитой.

Мы уже успешно выполнили 268 обзоров, в том числе для:




















Обзор доклинических и клинических исследований сэкономит Вам ресурсы в ходе подготовки регистрационного досье
В соответствие с N 61-ФЗ (ред. от 29.12.2015) «Об обращении лекарственных средств» Статья 18.
вместо отчета разработчика о результатах собственных доклинических исследований лекарственных средств и клинических исследований лекарственных препаратов для медицинского применения обзора научных работ
Краткая информация, чтобы мы могли с Вами связаться: ответить на вопросы и что-то посоветовать
Обзоры доклинических и клинических исследований препаратов для регистрации лекарственного препарата
Запросить коммерческое предложение — несложно, мы постараемся максимально быстро проанализировать Ваш проект и предложить готовое решение
- Ваши Персональные данные под защитой.
> Гарантируем результат в течение 2 лет после сдачи текста
> Ускоряем процесс регистрации
> Удешевляем процесс
> Ускоряем вывод воспроизведенного продукта на рынок
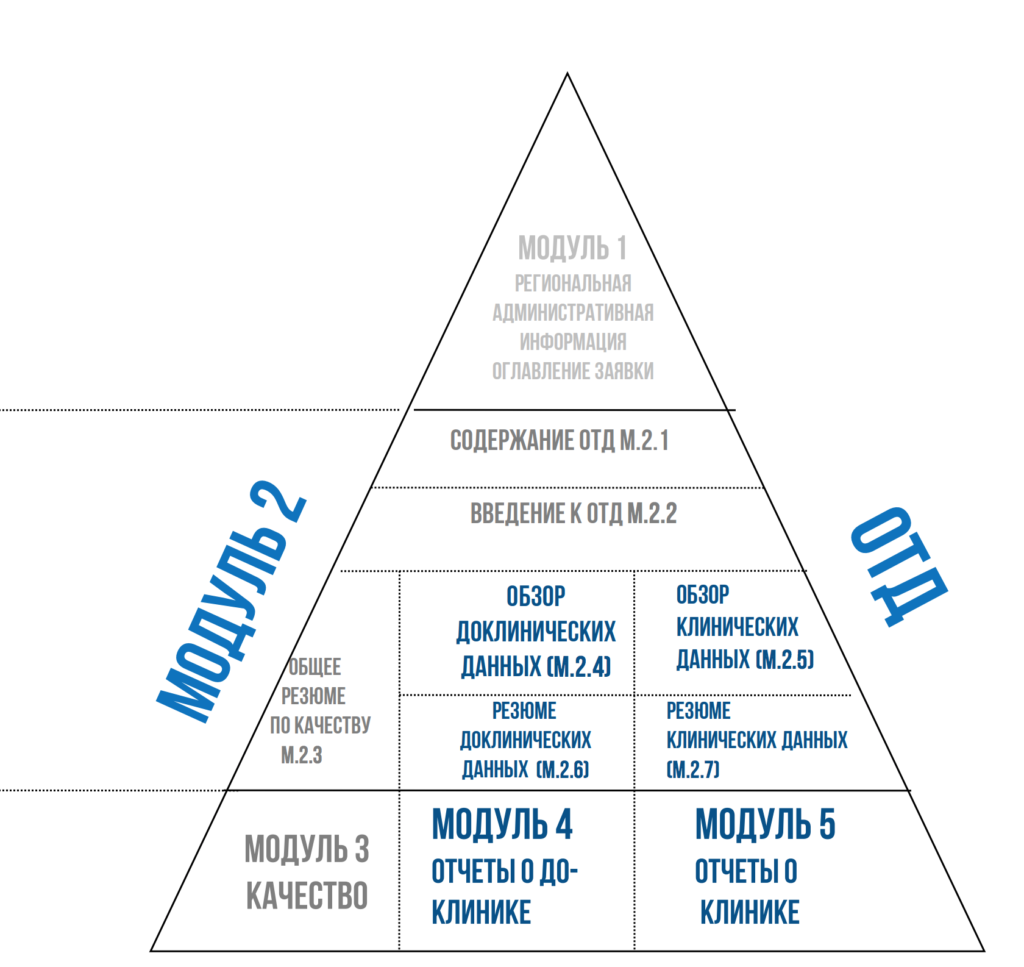
Для регистрационных задач лекарственных средств в формате Общего технического документа мы выполняем написание обзоров литературы для модулей:
М. 2.4-2.5 (доклинический и клинический обзор)
М. 2.6-2.7 (доклиническое и клиническое резюме
Модуль 4 (результаты собственных доклинических исследований, доклинический отчет)
Модуль 5 (результаты собственных клинических исследований, клинический отчет)
Краткая информация, чтобы мы могли с Вами связаться: ответить на вопросы и что-то посоветовать
Обзоры доклинических и клинических исследований препаратов для регистрации лекарственного препарата
Запросить коммерческое предложение — несложно, мы постараемся максимально быстро проанализировать Ваш проект и предложить готовое решение
- Ваши Персональные данные под защитой.
Наиболее частые вопросы
наших клиентов
Наши консультанты помогут ответить Вам на этот вопрос: воспроизведенные препараты различных классов, гибридные препараты, биоаналоги, для всех групп препаратов существуют свои особенности, мы готовы помочь Вам в стратегии регистрации до начала проекта
Да, мы сопровождаем клиента до успешной регистрации препарата и при необходимости вносим правки в предоставленный материал в течение 2х лет. |
При необходимости мы можем задействовать до 10 авторов и выполнять заказ исследовательской группой, что позволяет серьезно сократить итоговый срок выполнения заказа. |
Команда состоит из квалифицированных врачей и специалистов в биомедицинских науках, отобранных по России и СНГ и обученных по внутренней системе подготовки кадров НМА Литобзор. Опыт авторов в написании научных текстов достигает 22 лет.
В итоге заказчик получает комплект материалов — научный обзор литературы с внутренним цитированием научных источников и итоговым библиографическим списком литературы. Материалы готовы для включения в регистрационное досье или для подачи в Минздрав РФ в качестве информационного обоснования.
НМА Литобзор — агентство с длительной историей работы в области медицинской информации. Мы разработали и поддерживаем внутреннюю систему контроля качества работ; В работе используются российские и зарубежные базы данных, начиная от Elibrary, бумажных каталогов ЦНМБ ПМГМУ им. И.М. Сеченова и серой литературы, Pubmed и Embase до отчетов EMA, FDA. В ходе работ используются научная литература на английском, немецком, французском, а также оригинальные отчеты на азиатских языках
Два года достаточный срок для подачи большинства регистрационных досье. Если регулятор направит Вам замечания и уточнения на обзор, то наша система контроля качества оперативно обрабатывает запрос. Вполне возможно, что идентичный запрос уже поступал на этот же текст после сдачи версии Вам, поэтому у нас уже может быть обновленный текст, утвержденный регулятором и запрос будет обработан максимально быстро.
Не нашли ответ на свой вопрос? Задайте его, мы обязательно ответим!
Оставьте запрос, мы сами перезвоним Вам в удобное для Вас время
Ответ в течение 30 минут
Наш портфель законченных проектов
За 2015-2018 годы (с даты вступления поправки к Федеральному закону №61) агентство Литобзор выполнило 182 проекта по регистрации лекарственных средств с использованием обзоров научных работ.
В общей сложности 268 обзора из низ 163 — обзоры доклинических исследований, 105 — обзоры клинических исследований лекарственных средств для регистрационных целей.
Среди них инъекционные формы, твердые и мягкие лекарственные формы. Комбинированные и «монопрепараты».
В момент сдачи текста наша работа не заканчивается, мы делаем актуализации обзоров в среднем каждые 3 месяца, поэтому наш клиент может быть уверен, что в регистрационное досье лекарственного средства попадет самая свежая информация по безопастности и эффективности препарата.
Краткая информация, чтобы мы могли с Вами связаться: ответить на вопросы и что-то посоветовать
Обзоры доклинических и клинических исследований препаратов для регистрации лекарственного препарата
Запросить коммерческое предложение — несложно, мы постараемся максимально быстро проанализировать Ваш проект и предложить готовое решение
- Ваши Персональные данные под защитой.
Схема работы

Бесплатная консультация удобным для Вас образом
По телефону, почте или на сайте.
Мы со своей стороны делаем бесплатную экспертизу проекта: история обращения лекарственного средства на территории, где планируется подача. Изучение объема научной литературы по доклиническим и клиническим исследованиям референтного препарата;
Краткая информация, чтобы мы могли с Вами связаться: ответить на вопросы и что-то посоветовать
Обзоры доклинических и клинических исследований препаратов для регистрации лекарственного препарата
Запросить коммерческое предложение — несложно, мы постараемся максимально быстро проанализировать Ваш проект и предложить готовое решение
- Ваши Персональные данные под защитой.

Изучение регуляторной практики и подготовка плана
Консультирование заказчика по сложившейся регуляторной практике относительно лекарственной группы и лекарственной формы. Изложение потенциальных рисков при регистрации и подготовка плана будущего обзора литературы в составе регистрационного модуля;

Составляем экспертный обзор или актуализируем готовый из наших верифицированных баз
Подготовка обзоров научных работ и составление рекомендаций (при необходимости) по необходимому объему собственных доклинических и клинических исследований Заказчика;

Сопровождаем регистрацию до 2х лет
У регулятора возникли вопросы по обзору? Мы дополним тексты и составим грамотное обоснование
Поручите подготовкуобзора литературы профессионалам
- 268 успешных регистрационных проектов (для обращения ЛС в Российской Федерации и ЕАЭС) с момента вступления поправок в силу
- Большой накопленный опыт подготовки модулей
- Сопровождаем текст до успешной регистрации
- Воспроизведенные малые молекулы и биоаналаги
- Информационая служба с 2012 года

Запросите прайс!
в течение месяца действует скидка -10%
на готовые обзоры для регистрации ЛС или их актуализацию. Экономия составит до 160 000 руб.
Наши контактные данные
Наш офис находится по адресу:
г. Москва, Озерковская наб. 50 стр. 1, офис 26
Email: info@lit-review.ru
Телефон: + 7 (495) 646-49-75
Ответственный за практику медицинского письма (medical writing):
Мильчаков Кирилл Сергеевич, к.м.н.
Не нашли ответ на свой вопрос на странице -- закажите звонок, мы обязательно расскажем подробнее!
Оставьте запрос, мы сами перезвоним Вам в удобное для Вас время
Ответ в течение 30 минут
Эл. почта: info@lit-review.ru
Подготовка обзорных текстов для регистрационного досье в соответствии Федеральным законом от 12.04.2010 N 61-ФЗ (ред. от 29.12.2015) «Об обращении лекарственных средств» и в формате Общего технического документа (модули 2.4-2.7, 4 и 5) по Решению №78 ЕАЭС

(с) НМА Литобзор — информационное агентство доказательной медицины №1: обзор литературы, райтерские услуги, статистическая обработка данных для исследовательских и маркетинговых проектов в области медицины и фармацевтики